Y ahora que aprovecho a cerrar este blog, como último trabajo que hago en este curso y en este colegio, quiero agradecer a todos y a cada uno de los profesores que he tenido, todo lo que me han enseñado. Agradecerles también su paciencia y el apoyo a lo largo de 13 años. Les deseo mucha suerte a todos, y que sepan, que esta alumna siempre se acordará de ellos.
Un beso muy grande, Carmen :)
jueves, 13 de junio de 2013
Excepciones de los hidruros
AMONIACO >>> NH3
FOSFINA >>> PH3
ARSINA >>> ArH3
ESTIBINA >>> SbH3
METANO >>> CH4
SILANO >>> SH4
BORANO >>> BH4

FOSFINA >>> PH3
ARSINA >>> ArH3
ESTIBINA >>> SbH3
METANO >>> CH4
SILANO >>> SH4
BORANO >>> BH4


martes, 11 de junio de 2013
Compuestos más importantes
ÓXIDOS: Combinación de un elemento con el oxígeno.
Fe2O3 >>> Óxido férrico/Trióxido de dihierro
C2O >>> Anhídrido carbónico
CO2 >>> Dióxido de carbono
PERÓXIDOS: Contienen el grupo O2. No se pueden simplificar.
H2O2 >>> Peróxido de dihidrógeno
BeO2 >>> Peróxido de berilio
HIDRUROS: Combinación de un elemento con un hidrógeno.
KH >>> Hidruro potásico/Hidruro de potasio
FeH3 >>> Hidruro férrico/Hidruro de hierro (III)
HCl >>> Ácido clorhídrico/Cloruro de hidrógeno
HIDRÓXIDOS: Combinación de un metal + un elemento del grupo OH.
NaOH >>> Hidróxido de sodio/Hidróxido de sodio
Co(OH)2 >>> Hidróxido cobaltoso/Hidróxido de cobalto (II)
OXOÁCIDOS: Anhídrido + agua (H2O)
H2CO3 >>> Ácido carbónico/Trioxocarbonato(IV) de hidrógeno/Ácido trioxocarbónico (IV)
HNO2 >>> Ácido nitroso/Dioxo nitroso (II) de hidrógeno/Ácido dioxo nítrico (V)
SALES: Reacción entre un ácido + hidróxido
NaCl + H2O >>> Cloruro de sodio
RbClO2 >>> Dioxo clorato (V) de rubidio (I)
MgSO4 >>> Tetraoxo sulfato (VI) de magnesio (II)
Fe2O3 >>> Óxido férrico/Trióxido de dihierro
C2O >>> Anhídrido carbónico
CO2 >>> Dióxido de carbono
PERÓXIDOS: Contienen el grupo O2. No se pueden simplificar.
H2O2 >>> Peróxido de dihidrógeno
BeO2 >>> Peróxido de berilio
HIDRUROS: Combinación de un elemento con un hidrógeno.
KH >>> Hidruro potásico/Hidruro de potasio
FeH3 >>> Hidruro férrico/Hidruro de hierro (III)
HCl >>> Ácido clorhídrico/Cloruro de hidrógeno
HIDRÓXIDOS: Combinación de un metal + un elemento del grupo OH.
NaOH >>> Hidróxido de sodio/Hidróxido de sodio
Co(OH)2 >>> Hidróxido cobaltoso/Hidróxido de cobalto (II)
OXOÁCIDOS: Anhídrido + agua (H2O)
H2CO3 >>> Ácido carbónico/Trioxocarbonato(IV) de hidrógeno/Ácido trioxocarbónico (IV)
HNO2 >>> Ácido nitroso/Dioxo nitroso (II) de hidrógeno/Ácido dioxo nítrico (V)
SALES: Reacción entre un ácido + hidróxido
NaCl + H2O >>> Cloruro de sodio
RbClO2 >>> Dioxo clorato (V) de rubidio (I)
MgSO4 >>> Tetraoxo sulfato (VI) de magnesio (II)
domingo, 9 de junio de 2013
Formulación inorgánica
REGLAS GENERALES DE FORMULACIÓN TRADICIONAL:
-1. Si un elemento tiene 1 valencia: se le nombra con el nombre del elemento o el nombre acabado en -ico.
-2. Si un elemento tiene 2 valencias: Mínimo acabado en -oso, mayor acabado en -ico.
-3. Si un elemento tiene 3 valencias: El mínimo con prefijo hipo- y sufijo -oso. Medio acabado en -oso. Mayor acabado en -ico.
-4. Si un elemento tiene 4 valencias: El mínimo (hipo-nombre-oso). El medio inferior acabado en -oso. El medio superior acabado en -ico. Y el mayor, (per-nombre-ico).
REGLAS GENERALES DE FORMULACIÓN SISTEMÁTICA:
-1. Se nombran los elementos con el prefijo correspondiente al número que halla en la fórmula.
-2. Los prefijos más importantes son: Mono, di, tri, tetra, penta, hexa, y hepta.
REGLAS GENERALES DE LA FORMULACIÓN DE STOCK:
-1. Se nombre el elemento y a continuación se pone la valencia con la que actúa el elemento en la fórmula en números romanos y entre paréntesis.
-2. Cálculo de las valencias en las fórmulas:
A- Todas las valencias son neutras.
B- En oxígeno siempre se forma con carga -2.
C- El hidrógeno en fórmula, actúa con 1.
-1. Si un elemento tiene 1 valencia: se le nombra con el nombre del elemento o el nombre acabado en -ico.
-2. Si un elemento tiene 2 valencias: Mínimo acabado en -oso, mayor acabado en -ico.
-3. Si un elemento tiene 3 valencias: El mínimo con prefijo hipo- y sufijo -oso. Medio acabado en -oso. Mayor acabado en -ico.
-4. Si un elemento tiene 4 valencias: El mínimo (hipo-nombre-oso). El medio inferior acabado en -oso. El medio superior acabado en -ico. Y el mayor, (per-nombre-ico).
REGLAS GENERALES DE FORMULACIÓN SISTEMÁTICA:
-1. Se nombran los elementos con el prefijo correspondiente al número que halla en la fórmula.
-2. Los prefijos más importantes son: Mono, di, tri, tetra, penta, hexa, y hepta.
REGLAS GENERALES DE LA FORMULACIÓN DE STOCK:
-1. Se nombre el elemento y a continuación se pone la valencia con la que actúa el elemento en la fórmula en números romanos y entre paréntesis.
-2. Cálculo de las valencias en las fórmulas:
A- Todas las valencias son neutras.
B- En oxígeno siempre se forma con carga -2.
C- El hidrógeno en fórmula, actúa con 1.
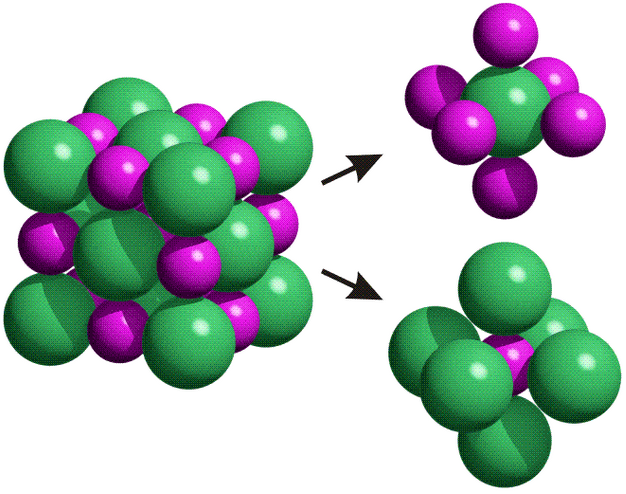
Enlace iónico!
El enlace iónico se basa en la trasferencia de electrones y consiste en la atracción electrostática entre iones con cargas opuestas.
Este tipo de enlaces se establece entre elementos metálicos y no metálicos, y tiene unas propiedades muy diferentes a las de el enlace covalente:
-Son sólidos cristalinos a temperatura ambiente.
-Los puntos de fusión y ebullición son muy elevados.
-Presentan resistencia a ser rayados.
-Son frágiles.
-Son buenos conductores de la electricidad cuando están fundidos.
-Son malos conductores de la electricidad en estado sólido.
-Son muy solubles en agua.
Este tipo de enlaces se establece entre elementos metálicos y no metálicos, y tiene unas propiedades muy diferentes a las de el enlace covalente:
-Son sólidos cristalinos a temperatura ambiente.
-Los puntos de fusión y ebullición son muy elevados.
-Presentan resistencia a ser rayados.
-Son frágiles.
-Son buenos conductores de la electricidad cuando están fundidos.
-Son malos conductores de la electricidad en estado sólido.
-Son muy solubles en agua.
Suscribirse a:
Entradas (Atom)